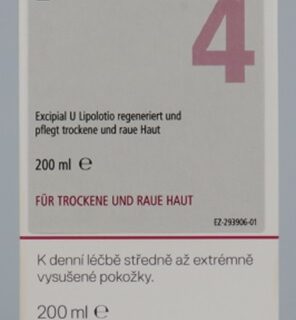
Rückruf: Gesundheitsgefahr – EurimPharm ruft „Excipial U Lipolotio“ Lotion zurück
Die EurimPharm Arzneimittel GmbH informiert über den Rückruf des Artikels Excipial U Lipolotio, 200 ml aufgrund bestehender Gesundheitsgefahr. Von diesem Rückruf sind insgesamt 6 Chargen betroffen. Wie das Unternehmen mitteilt, enthält der Artikel den nicht zugelassenen Stoff Butylphenyl Methylpropionat...